পোলার যৌগ কাকে বলে ও কিভাবে তৈরী হয়?

পোলার যৌগ কী, কিভাবে তৈরী হয়?
পোলের বাংলা মেরু, আর মেরুকে বিশ্লেষণ করলে দেখা যায় যে দুটো প্রান্ত, দুই রকম আধানের দুটো প্রান্ত। তড়িৎ ধনাত্মক (+) প্রান্তকে উত্তর মেরু আর তড়িৎ ঋণাত্মক (-) প্রান্তকে দক্ষিণমেরু হিসেবে চিহ্নিত করা হয়। পোলার যৌগ বোঝার জন্য অত কিছু প্রয়োজন নেই, শুধু উপরের ছবিটি লক্ষ্য করুন।
শুরুতেই আর একটি বিষয়ে একটু স্পষ্ট ধারণা রাখা চাই, তা হল “পরমাণুর আধান”, আমরা জানি যে, পরমাণুর আধান নির্ভর করে শুধুমাত্র ইলেক্ট্রনের উপর, অর্থাৎ কোন পরমাণুতে ইলেক্ট্রন বেড়ে গেলে তা তড়িৎ ঋণাত্মক হয়ে যায়, আবার কোন পরমাণুর ইলেক্ট্রন কমে গেলে তা তড়িৎ ধনাত্মক হয়ে যায়।
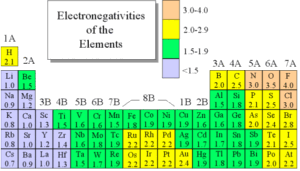
উপরের চার্ট টি পরমাণুর তড়িৎ ঋণাত্মকতার মান দেওয়া রয়েছে।
পোলার যৌগ কিভাবে তৈরী হয়?
আমরা জানি পরমাণু যখন ইলেক্ট্রন আদান প্রদান করে তখন তা আয়নিক যৌগ হিসেবে চিহ্নিত, আর সমযোজী যৌগগুলো ইলেক্ট্রন ভাগাভাগি করে ব্যবহার করে।আয়নিক যৌগে যেহেতু ইলেক্ট্রনের আদান-প্রদান ঘটে, তাই সেখানে পরমাণুগুলো তাদের কাছাকাছি অবস্থানে থাকা নিষ্ক্রিয় গ্যাসের গঠন অর্জন করে পাকাপোক্ত একটা অবস্থানে চলে যায়, তাই এখানে পোল তৈরী হবার কোন অবকাশই থাকে না। তাহলে বাকি রইল সমযোজী যৌগ, এখানে একই ইলেক্ট্রন দুটো পরমাণুই ব্যবহার করে, অর্থাৎ এখানে পরমাণুর ইলেক্ট্রনের ভারসাম্য ঠিক না হলেই একদিকে ঋণাত্মকতার মাত্রা বেড়ে যাবে, অর্থাৎ পোল তৈরী হবে।
দুটি পরমাণুর তড়িৎ ঋণাত্মকতার পার্থক্য যদি ০.৫ এর চেয়ে বেশি বা সমান হয়, তারা যদি কোন যৌগ গঠন করে, তখন সে যৌগে পোল তৈরী হয়, যে পরমাণুর তড়িৎ ঋণাত্মকতার মান বেশি সেটি ইলেক্ট্রনকে তার কাছে ধরে রাখে, এজন্য সে পরমাণুর তড়িৎ ঋণাত্মকতা বেড়ে যায়, আর এক দিকে যখন তড়িৎ ঋণাত্মকতা বা ইলেক্ট্রনের আধানের পরিমাণ বেড়ে যায়, অন্য পরমাণুতে ঠিক এর বিপরীত অবস্থার সৃষ্টি হয়, অর্থাৎ অপর পরমাণুতে চার্জ/আধানের ঘাটতি দেখা দেয়, একারণে সমপরিমাণ ধনাত্মক আধানের উদ্ভব হয়, একেই পোল সৃষ্টি বলে। আর এ ধরণের যৌগ পোলার যৌগ হিসেবে স্বীকৃত।
দুটো সহজ উদাহরণ দিয়ে শেষ করা যাক,
নন পোলার যৌগ: H-H, O-O, N-N, Cl-Cl, F-F, C-H ইত্যাদি।
উপরের উদাহরণ গুলো নন পোলার কেননা এদের মধ্যে তড়িৎ ঋণাত্মকতার পার্থক্য ০.৫ এর চেয়ে কম।
যেমন: CH এর ক্ষেত্রে, C এর তড়িৎ ঋণাত্মকতার মান, ২.৫ এবং H এর তড়িৎ ঋণাত্মকতার মান ২.১ এদের মধ্যে পার্থক্য = ২.৫-২.১ = ০.৪ এবং ০,৪ < ০.৫ , সুতরাং যৌগের অনুটি নন পোলার।
আবার,
HF এর ক্ষেত্রে, H = ২.১, F = ৪, এদের মাঝে পার্থক্য হল, ১.৯ যা ০.৫ এর চেয়ে অনেক বড়, তাই যৌগটি পোলার।
এরকম অসংখ্য উদাহরণ রয়েছে,
যেমন: সালফার ডাই অক্সাইড, হাইড্রোক্সাইড(পানি) ইত্যাদি।
পানি একটি পোলার যৌগ -ব্যাখ্যা
সমযোজী যৌগে দুটি ভিন্ন মৌলের দুটি ভিন্ন পরমাণুর মধ্যে শেয়ারকৃত ইলেকট্রন যুগল কোন একটি পরমাণু কর্তৃক তার নিজের দিকে আকর্ষণ করার ক্ষমতাকে তড়িৎ ঋণাত্মকতা বলে।
কোন যৌগে মৌলের পরমাণুর মধ্যে তড়িৎ ঋণাত্মকতার পার্থক্য 0.5 – 1.9 এর মধ্যে হলে যৌগটি পোলার সমযোজী হয়। পানি অণুতে দুটি হাইড্রোজেন পরমাণু একটি অক্সিজেন পরমাণুর সাথে সমযোজী বন্ধনে যুক্ত থাকে। অক্সিজেন পরমাণুর তড়িৎ ঋণাত্মকতা 3.5 এবং হাইড্রোজেন পরমাণু তড়িৎ ঋণাত্মকতা 2.1। এদের মধ্যে তড়িৎ ঋণাত্মকতার পার্থক্য = 3.5 – 2.1 = 1.4 যা (0.5 – 1.9)এর মধ্যে। অর্থাৎ পানি অনু পোলার সমযোজী যৌগ। পানিতে অক্সিজেন পরমাণুর তড়িৎ ঋণাত্মকতা বেশি হওয়ায় O – H বন্ধন ইলেকট্রন অক্সিজেন পরমাণু নিজের দিকে অধিক আকর্ষণ করে। যার কারণে অক্সিজেন পরমাণু আংশিক ঋণাত্মক চার্জিত ও হাইড্রোজেন পরমাণু আংশিক ধনাত্মক চার্জিত হয়।
একই যৌগের অণুতে দুটি ভিন্ন চার্জের সৃষ্টি হওয়াকে ডাইপোল বলা হয়। ডাইপোল সৃষ্টির ধর্মকে পোলারিটি এবং যেসব অনু ডাইপোল সৃষ্টি করে তাদেরকে পোলার অনু বলা হয়। পানি অনু যেহেতু ডাইপোল সৃষ্টি করতে পারে যেহেতু পানি একটি পোলার অনু। এজন্য পানি একটি পোলার যৌগ।