আধান বা চার্জ (charge) কি?

আধান বা চার্জ বলতে কি বুঝি?
আধান বা চার্জ: পদার্থ সৃষ্টিকারী এসব মৌলিক কণা সমূহের বৈশিষ্ট্যমূলক ধর্মকেই আধান বা চার্জ বলা হয়।
শীতকালে শুকননা চুল চিরুনি দিয়ে আঁচড়িয়ে তােমাদের প্রায় সবাই নিশ্চয়ই কখনাে না কখনাে ছােট ছােট কাগজের টুকরাকে সেই চিরুনি দিয়ে আকর্ষণ করেছ। শীতপ্রধান দেশে শীতকালে বাতাস খুব শুকনাে থাকে, তখন ছােট শিশু যখন কার্পেটে হামাগুড়ি দেয় তখন তাদের চুল খাড়া হয়ে যায়, দেখে মনে হয় একটি চুল বুঝি অন্য চুলকে ঠেলে খাড়া করিয়ে দিয়েছে।
তােমরা সবাই নিশ্চয়ই ঝড়ের রাতে আকাশ চিড়ে বিদ্যুতের ঝলককে নিচে নেমে আসতে দেখেছ।
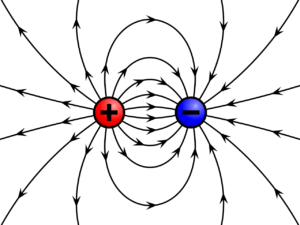
কাগজের আকর্ষণ, চুলের বিকর্ষণ কিংবা বজ্রপাত- এই তিনটি ব্যাপারের মূলেই কিন্তু একই বিষয় কাজ করেছে, সেটি হচ্ছে চার্জ বা আধান।
ঘর্ষণের ফলে এক বস্তু হতে অন্য বস্তুতে ইলেকট্রন স্থানান্তরিত হয়। তখন বস্তুসমূহ তড়িতাহিত হয়। ইলেকট্রনের চার্জধর্মী আচরণের কারণে বস্তু আধানগ্রস্ত হয়। এভাবে আধানের উৎপত্তি হয়। এছাড়াও পরিবহন (conduction), আবেশ (induction) আর মেরুকরণের (polarisation) কারণেও পদার্থের আধানপ্রাপ্তি ঘটে ।
চার্জ বা আধান কী, কেন সেটা কখনাে আকর্ষণ করে, কখনাে বিকর্ষণ করে আবার কখনাে বিদ্যুৎ ঝলক তৈরি করে বােঝার জন্য আমাদের একেবারে গােড়ায় যেতে হবে, অণু-পরমাণু কেমন করে তৈরি হয় সেটা জানতে হবে।
বৈদ্যুতিক আধান দুই প্রকার
যথা
- ধনাত্নক ও
- ঋণাত্মক (যথাক্রমে প্রোটন এবং ইলেকট্রন দ্বারা বাহিত)।
পৃথিবীতে কতগুলো অণু-পরমাণু আছে?
আমরা সবাই জানি সবকিছু অণু-পরমাণু দিয়ে তৈরি। পৃথিবীতে 118টি পরমাণু আছে, এর মাঝে মাত্র 83টি টেকসই, মাত্র এই কয়টি পরমাণু দিয়ে লক্ষ লক্ষ ভিন্ন অণু তৈরি হয়েছে। একটা অক্সিজেন পরমাণুর সাথে দুটো হাইড্রোজেন পরমাণু দিয়ে পানি, একটা সােডিয়াম পরমাণুর সাথে একটা ক্লোরিন পরমাণু দিয়ে লবণ, একটা কার্বন পরমাণুর সাথে চারটা হাইড্রোজেন পরমাণু দিয়ে রান্না করার গ্যাস ইত্যাদি ইত্যাদি।
(অবাক হবার কিছু নেই বাংলায় মাত্র পঞ্চাশটা বর্ণ, সেই বর্ণমালা, দিয়ে হাজার হাজার শব্দ তৈরি হয়েছে।
পরমাণু কি?
পরমাণু হচ্ছে সবকিছুর বিল্ডিং ব্লক (Building Block)।
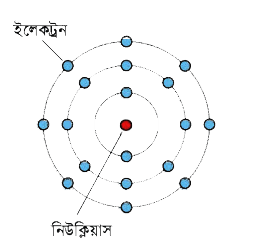
এই পরমাণুর কেন্দ্রে থাকে ছােট একটা নিউক্লিয়াস, তাকে ঘিরে ঘুরতে থাকে ইলেকট্রন। নিউক্লিয়াস তৈরি হয় প্রােটন আর নিউট্রন দিয়ে। এর ভেতরে প্রােটনের চার্জ হচ্ছে ধনাত্মক বা পজিটিভ (নিউট্রনের কোনাে চার্জ নেই) আর ইলেকট্রনের চার্জ ঋণাত্মক বা নেগেটিভ। প্রােটন আর ইলেকট্রনের চার্জ সমান কিন্তু বিপরীত
অর্থাৎ তার মান (1.6 x 10-19 coulomb) কিন্তু একটা পজিটিভ অন্যটা নেগেটিভ।
একটা পরমাণুর নিউক্লিয়াসে যে কয়টা প্রােটন থাকে তার বাইরে ঠিক সেই কয়টা ইলেকট্রন ঘুরতে থাকে তাই পরমাণুর সম্মিলিত চার্জ শূন্য, অর্থাৎ পরমাণু হচ্ছে বিদ্যুৎ নিরপেক্ষ বা নিস্তড়িৎ বা নিউট্রাল।
সবচেয়ে সহজ পরমাণু হচ্ছে হাইড্রোজেন, তার নিউক্লিয়াসটা হচ্ছে শুধু একটা প্রােটন, তাকে ঘিরে ঘুরছে একটা ইলেকট্রন।
এরপরের পরমাণু হচ্ছে হিলিয়াম, নিউক্লিয়াসে দুটো প্রােটন (এবং চার্জবিহীন দুটো নিউট্রন) আর বাইরে দুটো ইলেকট্রন। এভাবে আস্তে আস্তে আরাে বড় বড় পরমাণু তৈরি হয়েছে। হাইড্রোজেনকে যদি বাদ দিই তাহলে বলা যায় নিউক্লিয়াসে যতগুলাে প্রােটন থাকে কমপক্ষে ততগুলাে এবং সাধারণত আরাে বেশি নিউট্রন থাকে।
পরমাণু থেকে ইলেকট্রন আলাদা করার উপায়!
নিউক্লিয়াসের বাইরে ইলেকট্রনগুলাে সব একই কক্ষপথে থাকে না, চিত্রটিতে যেভাবে দেখানাে হয়েছে সেভাবে একটা কক্ষপথ পূর্ণ করে পরের কক্ষপথে যেতে থাকে। ভেতরের কক্ষপথের ইলেকট্রনগুলাে অনেক শক্তভাবে আটকে থাকে, তবে কিছু কিছু পরমাণুর বেলায় বাইরের কক্ষপথের ইলেকট্রনগুলােকে একটু চেষ্টা করলে আলাদা করা যায়। ইলেকট্রন আলাদা করার একটা উপায় হচ্ছে ঘর্ষণ।
এমনিতে পরমাণুগুলাে চার্জ নিরপেক্ষ অর্থাৎ প্রত্যেক পরমাণুতে সমান সংখ্যক প্রােটন আর ইলেকট্রন।
কিন্তু কোনাে কারণে যদি বাইরের কক্ষপথের একটা ইলেকট্রন সরিয়ে নেওয়া হয় তাহলে ইলেকট্রনের তুলনায় প্রােটনের সংখ্যা বেড়ে যায়।
অর্থাৎ পরমাণুটা আর বিদ্যুৎ নিরপেক্ষ বা নিউট্রাল থাকে না, তার ভেতরে পজিটিভ চার্জের পরিমাণ বেড়ে যায়।
একটা ইলেকট্রন সরিয়ে নিলে পরমাণুটিতে একটি পজিটিভ চার্জ হয়, দুটি সরিয়ে নিলে দুটি পজিটিভ চার্জ হয়। আমরা তখন বলি পরমাণুটি আয়নিত বা আহিত হয়েছে। একটা পরমাণু যে রকম পজিটিভভাবে আয়নিত হতে পারে ঠিক সে রকম নেগেটিভভাবেও আয়নিত হতে পারে
অর্থাৎ যখন বিচ্ছিন্ন একটি বা দুটি ইলেকট্রন পরমাণুর সাথে যুক্ত হয়ে যায়, তখন পরমাণুর মােট চার্জ হয় নেগেটিভ।
পরমাণুগুলাের ইলেকট্রনগুলাে তার কক্ষপথে ঘুরতে থাকে, এগুলাে কীভাবে সাজানাে হবে তার সুনির্দিষ্ট নিয়ম আছে। এখন তার গভীরে আমরা যাব না।
শুধু বলে রাখি কখনাে কখনাে শেষ কক্ষপথে একটি-দুটি ইলেকট্রন প্রায় মুক্ত অবস্থায় থাকে।
এ রকম পদার্থে ইলেকট্রনগুলাে খুব সহজে পুরাে পদার্থের মাঝে ছােটাছুটি করতে পারে। এ রকম পদার্থকে আমরা বলি বিদ্যুৎ পরিবাহী।
আবার কিছু কিছু পদার্থে ছােটাছুটি করার মতাে ইলেকট্রন নেই, যে কয়টি আছে খুব শক্তভাবে আবদ্ধ সেগুলাে হচ্ছে বিদ্যুৎ অপরিবাহী।
ধাতব পদার্থ যেমন সােনা, রুপা, তামা হচ্ছে বিদ্যুৎ সুপরিবাহী। কাঠ, প্লাস্টিক, কাচ, রাবার এসব হচ্ছে বিদ্যুৎ অপরিবাহী।
আধানের একক
আধান বা চার্জের এস আই (SI) একক হচ্ছে কুলম্ব (Coulomb)। কুলম্ব কে C দ্বারা প্রকাশ করা হয়।